Virtuális nanolaboratórium
Ivan Štich, Fizika Intézet,Szlovák Tudományos Akadémia, Pozsony
A mindennapi életben sokféle anyag vesz minket körül, legyen az fém, fa, műanyag, stb. Ezeket az anyagokat a centiméterektől a méterig terjedő skálákon mérhetjük le. Létezik egy másik típusú anyaggyártás is, amely a sokkal kisebb, ún. nanométeres skálát használja, 10-9 m, azaz az atomi mérlegeket. Napjainkban az atomi skálán speciális mikroszkóp segítségével tudunk vizsgálni anyagokat, mint például az atomi erőmikroszkóppal, amely a mikroszkóp csúcsa és a minta között ható erőket méri. Ez a mikroszkóp manipulálhatja az egyes atomok és molekulák töltését a felületükön egyetlen elektron pontosságú töltéssel.

Az atomi méretű laboratóriumi kísérletek mellett szükséges számítógépes szimulációk elvégzése is. Ezek a szimulációk gyakran szükségesek a végbement fizikai és kémiai folyamatok feltárásához. Figyelembe véve, hogy a mikroszkóp atomi skálán működik, a virtuális nanolaboratóriumnak meg kell oldania az atomi világ alapvető egyenletét, azaz Schrödinger egyenletét, amely az elektronok mozgását, mint az atomok egyik fő építőkövét írja le. Ez nagyon bonyolult, és csak a PFLOPs számítások (azaz több millió billió művelet/másodperc) elvégzésére alkalmas szuperszámítógépekkel végezhető el.
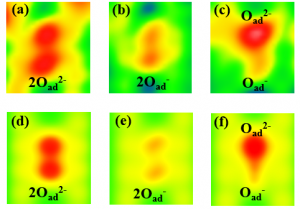
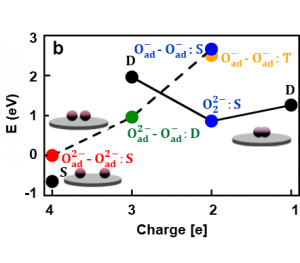
Nézzünk meg egy példát egy ilyen típusú laboratóriumi kísérletről és annak szimulációjáról. Az 1. ábra az atomi erőmikroszkóp által előállított kísérleti képeket ábrázolja. Láthatjuk az oxigénatomokat, amelyek a TiO2 felszínén rakódtak le, ahol atompárokat hozhatnak létre. Ezen a felületen, oxigénatomoknak az a kedvező, ha két elektront fogadnak be, azaz egy pár kettős töltésű atomot, O2–O2-, 1. ábra (a), amelyek alacsonyabb energiájúak, mint az egyedileg feltöltött atomok, O–O-, 2. ábra (d). Ezek az energiák a számítógépes modellezés eredményei, kísérleti úton nem könnyű ezeket meghatározni . Az atomi erőmikroszkóp segítségével az oxigénatomok töltéseit manipulálhatjuk, és más mesterséges atompárokat hozhatunk létre, mint például egyedileg feltöltött oxigénatomokat, O–O-, 1. ábra (b), vagy az O2–O- kombinációjukat, 1. ábra (c), melyek közül mindkettő sokkal nagyobb energiával rendelkezik, 2. ábra (d).
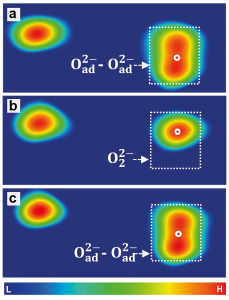
A számítógépes modellezés azt is lehetővé teszi számunkra, hogy ezt az értelmezést az atomi erőmikroszkópban lévő, különböző módon feltöltött oxigénatomok képeinek közvetlen szimulációján keresztül ellenőrizzük (1. ábra (d-f)), és hasonlítsuk össze a kísérlettel (1. ábra a). Amint a 2. ábrán látható, a töltés módosításával együtt az atomi erőmikroszkóp is képes létrehozni és megszakítani a felszínen lévő atomok közötti kémiai kötéseket. Ha a mikroszkóp két elektront távolít el a kettős töltésű atomokból, az O2–O2-, arra kényszeríti őket, hogy (reverzibilisen) kémiai kötést hozzanak létre és egy peroxidmolekulává, O22-, 2. ábra (c) alakuljanak át. Az a tény, hogy ez az értelmezés helyes, ugyancsak ellenőrizhető számítógépes szimulációkkal, 2. ábra (d). Ha a mikroszkópot két elektron eltávolítására használjuk az O2–O2-párból, és létrehozzuk az O–O- párt, akkor energetikailag kedvező, ha ez a néhány atompár peroxidmolekulává alakul át, 2. ábra (d). Ezzel ellentétben, ha két elektront juttatunk a peroxidmolekulába, akkor egy O24- molekula jön létre, amely instabil, és azonnal átalakul O2—O2- párrá. Az ilyen manipulációk megnyitják az utat a kémiai reakciókhoz, amelyek teljes mértékben szabályozhatók az atomi erőmikroszkóppal végzett töltéskezeléssel.
1. ábra. Az oxigénatomok különböző töltési állapotokban a TiO2 felületén. Az atomi erőmikroszkópból (a-c) kísérleti úton kapott képek és számítógépes szimulációk (d-f).
2. ábra: A feltöltött oxigénatomok peroxidmolekulává (a-c) való visszafordítható kezelése. Számítógépes szimulációkkal számított energiák (d). A nyilak reverzibilis manipulációs folyamatokat mutatnak, amelyek az atomok molekulává alakuló reakcióját eredményezik.

