Genetikai mutációk és az Alzheimer kór
Projekt neve: FEHERJEK; Projektvezető: Paragi Gábor
MTA-SZTE Biomimetikus Rendszerek Kutatócsoport, Szeged, Magyarország, PTE Fizika Intézet, Pécs, Magyarország
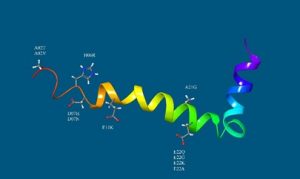
Az Alzheimer-kór egy olyan betegség, amely az agyat érinti, szellemi leépüléshez és más fontos kognitív funkció elvesztéséhez vezet. Bár a betegség nem örökletes, azonban bizonyos genetikai tényezők megváltoztathatják a betegség kialakulásának valószínűségét. A kutatások azt mutatták, hogy a betegeknél megfigyelhető agykárosodásért, és ezen keresztül a szellemi leépülésért, az agyban felhalmozódó amiloid β peptid (Aβ-peptid) aggregációja (nagyszámú peptid rendezett összetapadása) lehet a felelős. Az Aβ-peptid egy 42 aminosavból álló fehérjeszakasz, amit a szervezetben levő enzimek vágnak ki a többszáz aminosavból álló amiloid fehérjéből. A kutatók azt tapasztalták, hogy minden egyes Alzheimerben elhunyt beteg központi idegrendszerében jelen van az Aβ-peptid aggregált alakja. Ebből előszőr arra következtettek, hogy ez az aggragált forma felelős a betegségért. Az utóbbi évtizedben azonban nyilvánvalóvá vált, hogy nem a végső aggragált alak a legkárosabb az idegsejtek számára. Kiderült, hogy az aggragált forma keletkezése közben egy mindmáig ismeretlen szerkezetű, kis számú peptidből álló úgynevezett oligomer állapot (Aβ-oligomer) tehető leginkább felelőssé az idegsejtek pusztulásáért.
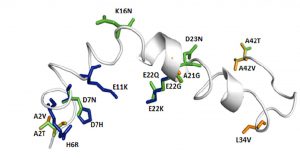
Paragi Gábor és kollégái (MTA-SZTE Biomimetikus Rendszerek Kutatócsoport, Szeged és Pécsi Tudományegyetem Fizika Intézet) azt vizsgálják számítógépes módszerekkel, hogy mi befolyásolja az Aβ-oligomer kialakulását. A mérgező Aβ alak keletkezésében az első lépés a különálló (monomer) Aβ-peptidek összetapadása kis oligomerekké. Nyilvánvaló, hogy egy igen mozgékony Aβ monomer pillanatnyi geometriája nagyban befolyásolja a kezdeti összetapadást. Ezt a kérdést bonyolítja tovább egy mutáció jelenléte, mivel az hatással van a monomer Aβ-peptid által magvalósítható alakok sokaságára. A mutáció segítheti vagy nehezítheti a monomer Aβ-peptidek összekapaszkodását, azaz még károsabbá, vagy épp ellenkezőleg, az alap esethez képest is kevésbé mérgezővé alakíthatja az Aβ-peptidet.
A kutatócsoport a debreceni HPC központ (Leó) számítógépes erőforrásainak felhasználásával azt elemezte, hogy miként változtatja meg egy ismert hatású mutáció valamely Aβ-monomer által felvehető geometriák sokaságát. Megállapították, hogy a mutációk számos jól ismert molekulán belüli kapcsolatot (például elektrosztatikus kölcsönhatást) megváltoztatott, ezáltal befolyásolva a lehetséges alakjait a molekulának. A vizsgálatok remélhetőleg hozzájárulnak a betegség molekuláris hátterének mélyebb megértéséhez, valamint elősegíthetik új gyógyszermolekula tervezését.
Szeretnénk köszönetet mondani a számítógépes erőforrás biztosításához a Debrecen2 (Leó) GPU klaszteren. A kutatómunkát a magyar kormány GINOP-2.3.2-15-2016-00034 és GINOP-2.3.2-15-2016-00032 számú pályázat támogatásával végeztük.