Projekt címe: ABCFEH
Projektvezető: Hegedűs Tamás
MTA-SE Molekuláris Biofizikai Kutató Csoport, Magyar Tudományos Akadémia, Budapest, Biofizikai és Sugárbiológiai Intézet, Semmelweis Egyetem, Budapest, Magyarország
A cisztás fibrózis magas halandósági rátájú, a kaukázusi populációban a leggyakoribb monogénes betegség. A betegség legfőbb oka, hogy nincs klorid-áramlás a légúti hámsejtekből a légutak felszínét borító váladékba, ami abnormálisan sűrű folyadékot eredményez. Ez a csillók mozgását gátolja és megakadályozza a por és a baktériumok eltávolítását. Hasonló folyamatok az emésztő rendszerben (bél, hasnyálmirigy) is problémát okoznak. Ugyanakkor a bőrben nem történik klorid-visszaszívás az izzadságból, így a betegek elveszítenek egy fontos iont. A magas sóveszteség könnyen érzékelhető, és a rontás diagnózisára használták a XV. század végén, amit egy ír szólás is megörökített: “Jaj annak a gyermeknek, akinek a homlokán sós a csók. Elbűvölték és hamarosan meg kell halnia.“
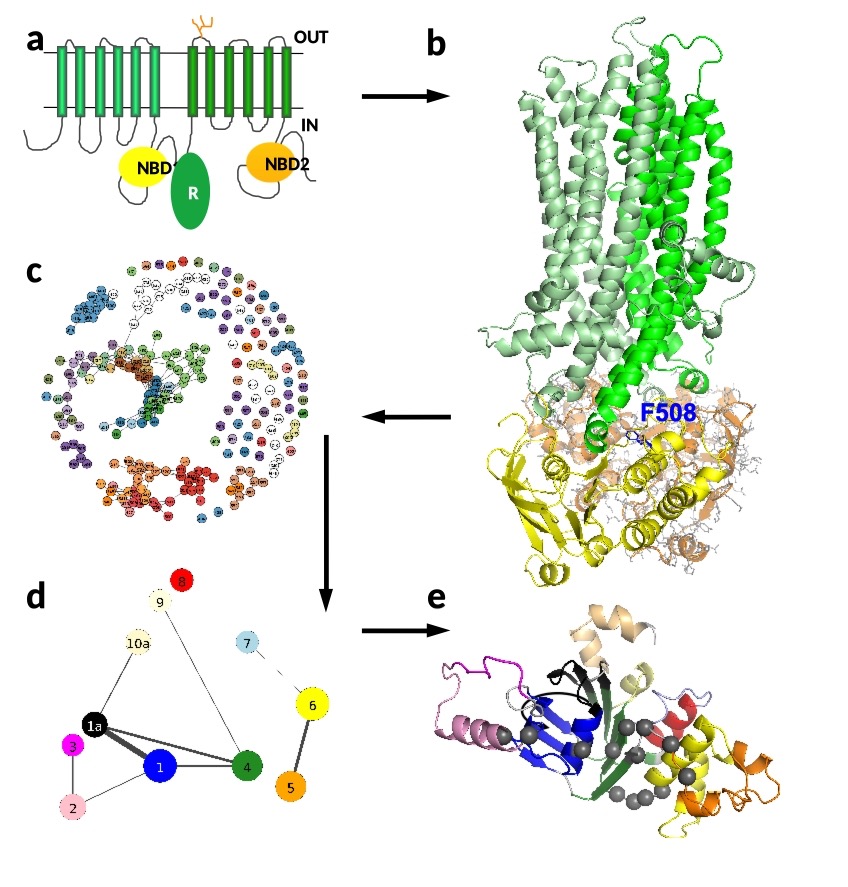
A cisztás fibrózis betegséget a CFTR fehérje, egy, a sejtmembránban elhelyezkedő klorid csatorna génjének mutációi okozzák. Ha a fehérje mutálódik, az hatással van a szerkezetére, feltekeredésére és dinamikájára. A kutatók fő célja olyan gyógyszerek tervezése, amelyek a CFTR normál szerkezetét és dinamikáját helyreállítják és kijuttatják a csatornát sejtmembránba. A fehérjeszerkezet ismerete elősegíti gyógyszerek tervezését és a fehérje kijavítását. A CFTR szerkezetét 6+6, a sejtmembránt átérő transzmembrán hélix, és két intracelluláris nukleotidkötő domén (NBD1, NBD2) alkotja (a és b ábra: NDB1 sárga; NBD2 narancs, amelynek az összes atomját ábrázoltuk, de a többi rész leegyszerűsített az átláthatóság érdekében. Az 508-as fenilalanin mutálódik a leggyakrabban (b ábra: az F508 kék pálcika modellel jelölve). Ennek a fenilalaninnak a deléciója (ΔF508) nem csak az NBD1 (sárga) és transzmembrán helix (zöld) közötti kölcsönhatásokat bontja meg, hanem az NBD1 stabilitását is befolyásolja.
Mivel az atomok mozgásának kísérletes megfigyelése fehérjékben rendkívüli kihívást jelent vagy a legtöbb esetben egyenesen lehetetlen, ezért fizikai alapokon nyugvó in silico módszereket alkalmaztunk a fehérje mozgásának kiszámítására, így egy filmet kaptunk a molekuláris szintű mozgásokról. (http://www.hegelab.org/md.html). Bár egy vagy két atom mozgása könnyen kiszámítható, az egy fehérjében található több százezer atom esetében nagy erőforrások szükségesek. Ezt nem csak az atomok nagy száma okozza, hanem az atomok közötti bonyolult, nagy-távolságú kölcsönhatások, mint például az elektrosztatikus kölcsönhatás is. Ezért ezekhez az úgynevezett molekuladinamikai számításokhoz nagy teljesítményű számítási erőforrásokra van szükség (pl. számos CPU-val és több GPU-val rendelkező számítógépekre).
A számítások elemzése, amelyekben különböző statisztikai és hálózatkutatási módszereket alkalmazunk, szintén kihívást jelent. Aminosavak hálózatát (c, d) vizsgálva azonosítottuk a csomópontok közötti kommunikációban fontos aminosavakat (e), amelyek lehetővé teszik a káros mutációk hatásának terjedését. Ezek az aminosavak potenciális célpontjai lehetnek gyógyszer-molekuláknak.
Eredményeink alapján in silico módszerrel tesztelhető több ezer molekula kötődése a kritikus helyekre. A legjobbnak bizonyuló találatokat, amelyek általában kevesebb, mint száz gyógyszerjelöltet jelentenek, tovább tesztelhetjük kísérleti módszerekkel. A kísérletekben hatékony és nem-toxikus molekulák vezér molekulák lesznek későbbi fejlesztésekben és klinikai vizsgálatokban. Összefoglalva, a biológiai, fizikai és matematikai ismeretek ötvözése segíthet a mutációk fehérjék szerkezetére és dinamikájára kifejtett hatásának megértésében, a gyógyszerkötés helyének azonosításában, és olyan betegségek, mint pl. a cisztás fibrózis kezelésének kifejlesztésében.