Vedoucí projektu: Tamás Hegedűs
Instituce: Skupina pro výzkum molekulární biofyziky MTA-SE, Maďarská akademie věd, Budapešť, Maďarsko a Katedra biofyziky a radiační biologie, Univerzita Semmelweis, Budapešť, Maďarsko
Cystická fibróza je nevyléčitelné dědičné onemocnění s vysokou úmrtností u kavkazské populace. Nemocným se v dýchacích cestách tvoří hustý hlen, ve kterém se dobře usídlují bakterie a nečistoty. Nemocní také špatně tráví potravu, protože jim nefunguje správně slinivka břišní produkující trávicí enzymy. Na druhé straně, v organismu se nemocným nezadržuje chlorid, a pacienti tak potem ztrácejí velice důležitý iont. Vysoká ztráta soli může být snadno rozpoznána a slouží pro diagnózu nemoci. Koncem patnáctého století byla dokonce zneužívána v čarodějnických procesech a vyjádřena je i v irském přísloví: „Běda tomu dítěti, které chutná slaně, když je políbeno na čelo. Ono očarované je a brzy musí zemřít.“

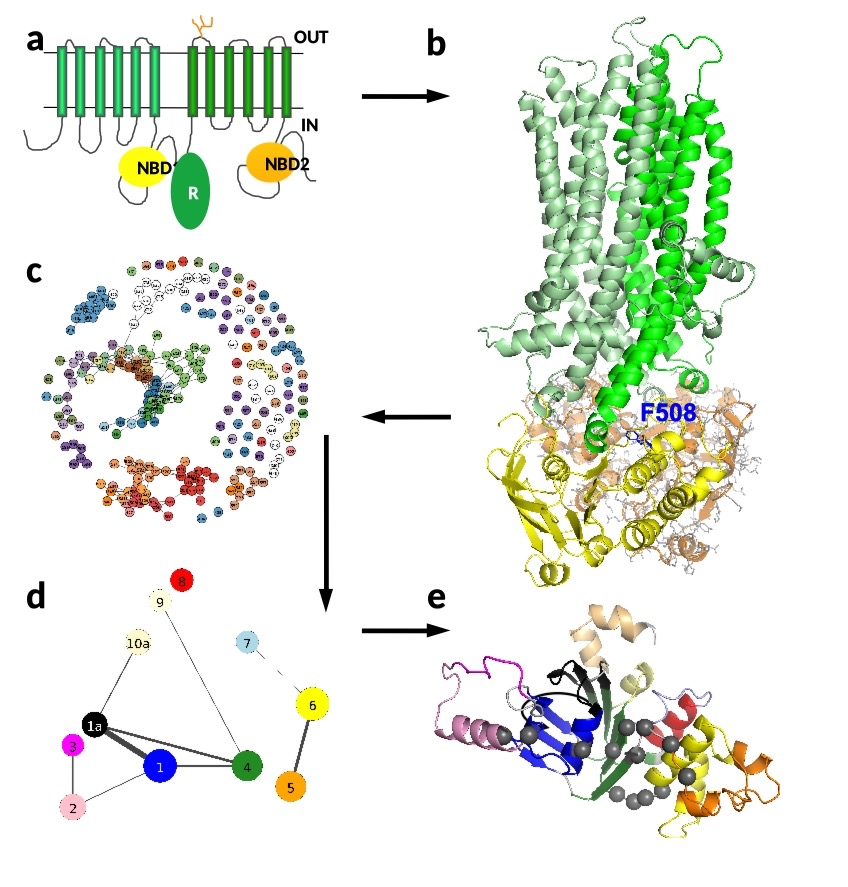
Cystická fibróza je způsobena mutacemi v genu CFTR, který řídí činnost tzv. chloridového kanálu v buněčné membráně. Když tento gen zmutuje, je ovlivněna struktura, skládání a dynamika kanálu. Hlavním cílem v dané oblasti je navrhnout léky pro obnovení jeho normálních strukturních a dynamických vlastností. Znalost struktury proteinů usnadňuje návrh a úpravu léčiv (a). Struktura CFTR se skládá ze 6 + 6 transmembránových helixů, které procházejí buněčnou membránou, a dvou intracelulárních nukleotidových / ATP vazebných domén (NBD1 a NBD2). Všechny atomy NBD2 jsou ukázány pro demonstraci, ale ostatní části byly zjednodušeny pro usnadnění vizualizace (b). Nejčastěji mutovaná aminokyselina F508 je zvýrazněna modrými tyčinkami. Delece tohoto fenylalaninu (AF508) narušuje nejen interakci mezi NBD1 (žlutá) a transmembránovými helixy (zelená), ale současně ovlivňuje stabilitu NBD1.
Protože experimentální pozorování pohybů atomů v proteinech patří ve většině případů k extrémně náročným nebo dokonce nemožným úkolům, využívá se pro výpočet pohybů založených na fyzice metody in silico (simulace na počítačích). Výsledkem je video, které zachycuje děje na molekulární úrovni (http://www.hegelab.org/md.html). Pohyb jednoho nebo dvou atomů lze vypočítat snadno, stovky tisíc atomů v proteinu jsou už ale na výpočet náročné. Je to způsobeno nejen vysokým počtem atomů, ale i komplikovanými interakcemi mezi atomy na dlouhé vzdálenosti – jedná se například o elektrostatiku. Proto tyto takzvané výpočty molekulární dynamiky vyžadují vysoce výkonné výpočetní prostředky (např. počítače s velkým počtem výpočetních jader a akcelerátory GPU).
Analýza takto získaných výsledků je rovněž náročná a vychází z různých statistických a síťových metod. Zkoumáním povahy komunit v síti aminokyselin (c, d) můžeme identifikovat ty kritické (e), které nejspíše umožňují šíření potenciálně škodlivých mutací v širší komunitě aminokyselin. Ty se pak stávají potenciálními cíli pro léky, které mohou dané šíření zastavit.
Na základě výsledků skupiny vědců kolem Tamáse Hegedűse může být vazba tisíců molekul na toto kritické místo testována in silico (na superpočítači). Ty nejslibnější vypočítané možnosti, které obvykle zahrnují pouze desítky kandidátů na léčiva, mohou být dále testovány experimentálními metodami. Experimentálně účinné a netoxické molekuly se stávají vedoucími molekulami pro další vývoj a klinické testy. Souhrnně lze říci, že spojení znalostí biologie, fyziky a matematiky může pomoci pochopit vliv mutací na strukturu a dynamiku proteinu, identifikaci místa vazby léků a potenciálně vést ke vzniku léku na onemocnění, jako je například cystická fibróza.